مقدمه ای بر فلوسایتومتری
سرعت و دقت آنالیز با فلوسایتومتری
فلوسايتومتري روش دستگاهي بسيار سريع و قدرتمندي است كه براي شناسايي ذرات (سلولها) و ارزيابي خصوصيّات آنها به كار ميرود. ذرات مورد آزمايش به صورت معلق در مايع با سرعتي حدود 5 تا 50 متر در ثانيه از ميان منفذي باريك و از مقابل پرتوي باريك از نور ليزر عبور ميكنند بدين ترتيب امكان جمعآوري اطلاعات مربوط به 5000 تا 50000 سلول در هر ثانيه فراهم ميشود. غالباً حجم مورد نياز از نمونه مورد آزمايش نيز خيلي كم و حدود 100 ميكروليتر ميباشد. در مورد دقت آن نيز بايد گفت كه قادر است تعداد 1 سلول سرطاني در ميان 10000 تا 100000 سلول عادي موجود در نمونة مغز استخوان را شناسايي كند. فلوسايتومتري در بخشهاي تحقيقاتي و در آزمايشگاههاي تشخيصي كاربرد وسيعي دارد و براي تشخيص بيماريها، تعيين پيش آگهي و هم براي ارزيابي درمان بدخيميها كاربرد دارد.اساس فلوسایتومتری
اين روش بر خصوصيات پراكنده سازي نور توسط سلولها (شكل 1) و نيز بر نشر فلورسانس از آنها (شكل 2) استوار است. نشر فلورسانس ميتواند با استفاده مستقيم از مواد رنگكننده فلورسنت حاصل ميشود (مثل رنگ كنندههاي DNA يا RNA كه هم خصوصيت فلورسانس بودن را دارا هستند و هم خود انتخاب ميكنند كه به كدام جزء سلولي متصل شوند) يا تركيبي از رنگ فلورسنت با آنتيباديهاي مونوكلونال تحت نام عمومي كونژوگه مورد استفاده قرار ميگيرد. در اين حالت انتخاب محل اتصال به سلول، توسط جزء آنتيبادي موجود در كونژوگه صورت ميگيرد و اين آنتيبادي است كه به صورت كاملا اختصاصي آنتيژن هدف را بر روي سلول يا در داخل آن شناسايي كرده و به آن متصل ميشود و جزء فلورسنت موجود در كونژوگه ابزاري براي رديابي محل و ميزان آنتيباديهاي متصل شده به هدف ميباشد.منشاء نور در فلوسایتومتری
اگر چه سلولها بخوديخود داراي فلورسانس اندكي در برخي طول موجها هستند اما بدون بكارگيري نور تهييج كننده كه غالباً ليزر ميباشد هيچ سيگنالي توليد و به رديابهاي دستگاه ارسال نخواهد شد. سيگنالهاي رديابي شده توسط دستگاه يا از منشاء نور ليزر دستگاه ميباشد كه پس از برخورد به سلول در جهات مستقيم (forward scatter) يا عمود بر محور تابش ليزر (side scatter) پراكنده شده و به رديابها ميرسد و يا از منشاء فلوروكروم متصل به سطح ذره ميباشد. فلوروكرومهاي متصل شده به سطح يا داخل سلول بر اثر تابش نور ليزر تهييج شده و انرژي نور تابيده شده را جذب كرده و سپس در طول موج ديگري به صورت تابش فلورسانس آزاد ميسازند.
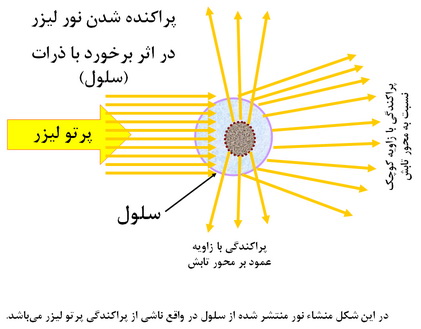
شكل 1
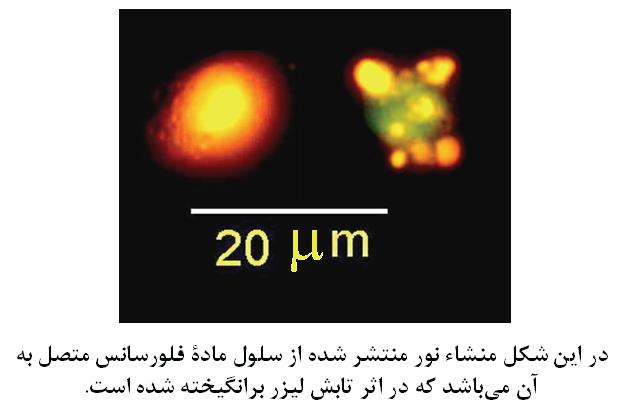
شكل 2
هدفگیری مولکول ها با آنتی بادی های نشاندار شده با فلوروکروم
سلولها از اجزاء مختلفي مثل غشاء سيتوپلاسمي، غشاء هستهاي، هسته و سيتوپلاسم تشكيل ميشود و تقريبا همه مولكولهاي موجود در قسمتهاي مختلف سلول را ميتوان با استفاده از فلوسايتومتري رديابي و تعيين مقدار نمود. معمولاً مولكولهاي سطحي موجود در غشاء سيتوپلاسمي براحتي در دسترس آنتيبادي قرار ميگيرند ولي براي رسيدن آنتيبادي يا مادة فلورسانس به مولكولهاي دروني سلول روشهاي مطمئن و موثري لازم است.هر سلولي بر حسب نوع و تخصصي كه به عهده دارد مولكولهاي مختص به خود را بيان ميكند، بدين معني كه همة ژنها در همة سلولها بيان نميشوند بلكه برحسب وظيفهاي كه در طي تمايز بر عهدة سلول گذاشته شده است و بر حسب محيطي كه در آن قرار ميگيرد هر سلولي خود انتخاب ميكند كه در پاسخ به شرايط محيطي كدام ژن را فعال سازد. بنابر اين رديابي پروتئينهاي سلولي حاصل از بيان ژنها هم در سطح و هم در درون سلول ميتواند وسيلهاي بسيار مفيد براي شناسايي سلول باشد.
مولكولهاي سطحي سلولها تحت نام عمومي CD كه مخفف Cluster Differentiation ميباشد شناخته ميشوند و براي رديابي آنها از آنتيباديهاي منوكلونال كونژوگه با فلوروكروم استفاده ميشود. مثلا ماركرهاي سطحي سلولهاي NK عبارتند از CD16 و CD56 كه آنتيباديهايي با همين نام قادرند اين مولكولها را در سطح سلول شناسايي نمايند. اغلب لفظ آنتيبادي در گفتار يا نوشتار حذف ميشود مثلاً كونژوگه CD16 همان آنتيبادي شناسايي كننده CD16 ميباشد كه متصل به فلوروكروم است. يا كونژوگه CD34 اشاره به آنتيبادي شناسايي كنندة CD34 دارد كه با فلوروكروم مناسبي كونژوگه شده است ( CD34 ماركر اختصاصي سلولهاي ريشهاي تمايز نيافته مغز استخوان ميباشد).
با استفاده از فلوسايتومتري محصولات پروتئيني ژنها در داخل سلول نيز قابل رديابي هستند و نامگذاري آنتيباديهاي مورد استفاده براساس نام پروتئين مورد نظر صورت ميگيرد. مثلاً پروتئين Zap-70 ساروگيت ماركر براي موتاسيونهاي ناحيه متغير زنجيره سنگين ايمونوگلوبولين ميباشد و در تعيين زير گروههاي CLL اهميت دارد و توسط آنتي بادي با همين نام قابل شناسايي است.
فلوسايتومترهاي اوليه قادر بودند فقط يك يا دو رنگ فلورسانس را تجزيه و تحليل كنند اما امروزه دستگاههايي عرضه شدهاند كه قادرند يازده رنگ فلورسانس را به طور همزمان رديابي و تجزيه و تحليل كنند. اساس و نحوة كار فلوسايتومتر بحث پايهاي براي درك روشهاي مختلف فلوسايتومتري است.
آماده سازی سلول ها
براي انجام فلوسايتومتري لازم است كه ابتدا سلولها با فلوروكرومها نشاندار شوند. از طرفي براي نشاندار كردن اجزاء داخلي سلول بايد اقدامات خاصي را انجام داد تا آنها در دسترس آنتيبادي يا ماده فلورسنت قرار گيرند روشهاي رنگآميزي با فلوروكرومها و استفاده از مواد نفوذپذير كننده متنوع براي نفوذپذير كردن سلولها خود بحث ديگري است كه بايد جداگانه به آن پرداخته شود.تعداد فلوروكرومهاي مورد استفاده براي فلوسايتومتري در طي ساليان متمادي مرتباً افزايش يافته است و اين احتمال وجود دارد كه در آينده، تعداد فلوروكرومهاي مورد استفاده براي آناليز سلولها بيش از اين نيز افزايش يابد. شناخت انواع فلوروكرومها و آگاهي از مزيتها و معايب هر كدام تنها راه استفاده بهينه از آنها براي دستيابي به مقاصد علمي تحقيقاتي است.
براي انجام هر نوع فلوسايتومتري ابتدا بايد سلولها را آماده كرد به طوري كه سلولها به صورت تكي در آمده و در محيط مناسبي معلق شده باشند. بعضاً يك مرحله تخليص براي بالا بردن غلظت سلولهاي مورد نظر در نمونه ضرورت پيدا ميكند روشهاي مختلفي براي تهيه، تخليص و آماده سازي سلول وجود دارند و روش انتخاب شده به نوع سلول مورد ارزيابي بستگي دارد.
پس از تهيه سوسپانسيون مناسب، سلولها بايد با مواد فلورسانس رنگ شوند و يا با آنتيباديهاي كونژوگه با فلوروكروم نشاندار شوند. روش نشانداركردن تحت تاثير فاكتورهاي زيادي قرار ميگيرد از جمله: ميزان اختصاصي بودن آنتيبادي و غلظت آنتيژن در سطح يا داخل سلول، مناسب بودن غلظت آنتی بادی مورد استفاده و به کار بردن كنترلهاي مثبت و منفي مناسب در آناليز سلولها.
کنترل کیفی و منشاء خطاها در فلوسایتومتری
داشتن برنامههاي كنترل كيفي براي روشها و تجهيزات در هر نوع فلوسايتومتري ضروري بوده و يك نياز اساسي محسوب ميگردد. اين برنامهها براي اطمينان از كيفيت نتايج بدست آمده به كار برده ميشوند. همچنين برنامههاي كنترل كيفي بايستي مرتباً و در حد كفايت انجام شوند تا تشخيص نقاط اشكال به آساني ممكن گردد. بدين منظور، برنامة كنترل كيفي در هر دو زمينة، كنترل كيفي داخلي و روشهاي ارزيابي كيفي خارجي، بايد به اجرا گذاشته شوند.در فلوسايتومتري طي دو مرحلة جمعآوري اطلاعات و مرحلة آناليز اطلاعات امكان خطا وجود دارد كه با به كارگيري روش صحيح تهية نمونه سلولي و تنظيم دقيق دستگاه ميتوان از خطاهاي مربوط به مرحلة جمعآوري اطلاعات جلوگيري كرد اما توانايي اپراتور در طراحي صحيح آزمايش، تنها جنبهاي از كسب اطلاعات است كه براي آن روشهاي كنترل خطا وجود ندارد. بدين معني كه انتخاب آنتيبادي مناسب و انتخاب فلوروكروم متناسب با غلظت و موقعيت آنتيژن نيازمند تجربيات و اطلاعاتي است كه بايد توسط محقق كسب شوند.
بررسی آپوپتوزیس سلول با فلوسایتومتری
آپوپتوز يكي از شكلهاي مرگ سلول ميباشد كه از نظر بيولوژي اهميت زيادي دارد و به همين دليل رديابي و اندازهگيري آپوپتوز در تحقيقات و موارد باليني اهميت پيدا ميكند. سلولهاي در حال آپوپتوز نشانههاي زيادي دارند كه قابل اندازهگيري با فلوسايتومتري ميباشند اين نشانهها عبارتند از تغييرات در غشاء پلاسمائي سلول، تغييرات در نفوذپذيري غشاء پلاسمائي، تغييرات در نفوذپذيري غشاء ميتوكندري، فعالسازي كاسپازها و شكستگيهاي DNA سلولي. شناسايي هر يك از اين تغييرات به تنهايي يا تركيبي از آنها به وسيلة فلوسايتومتري، امكان شناسايي و اندازهگيري سلولهاي آپوپتوتيك را از ميان مخلوطي از سلولهاي ديگر فراهم ميكند همچنين اطلاعات با ارزشي در بارة مسير مولكولي مرگ سلولها به دست ميآيد.آنالیز DNA با فلوسایتومتری
دسترسي به رنگهای فلورسنتي که به صورت خطی و متناسب با غلظت به DNA سلولي متصل میشوند فلوسایتومتری را برای آنالیزDNA توانمند ساخته است. امروزه تعیین کمی مقدار DNA، شناسایی سلولهای دیپلوئید نرمال در حالت استراحت، شناسايي سلولهايي كه به طور فعال DNA سنتز ميكنند و شناسايي سلولهايي كه در مرحلة پیش میتوز و یا میتوز هستند توسط فلوسايتومتر امكان پذير شده است. هنگامي كه فازهای مختلف چرخة زندگي سلولها مشخص شدند، ميتوان با توامكردن روشهاي رديابي پروتئینهای مؤثر در چرخة سلولی به وسيلة آنتيباديهاي اختصاصي و روش تعيين مقدار DNA بيان پروتئينها را در فازهاي مختلف زندگي سلولها بررسي كرد. اضافهنمودن آنالوگ تیمیدین يا بروموداکسی یوریدین به محيط كشت سلولي امكان شناسایی سلولهایی را فراهم ميكند که فعالانه در حال سنتز DNA هستند. با استفاده از روش تعيين مقدار DNA همچنين ميتوان تعداد کروموزومها (هنجار یا ناهنجار) را مشخص كرد. سلولهايي كه به حالت پلوئیدی (برای مثال در مگاکاریوسیتها) و يا آناپلوئیدی (برای مثال در بیماریهای بدخیم) ميباشند نيز با اين روش قابل شناسايي هستند.فلوسایتومتری در ارزیابی سلول های سیستم ایمنی
روش فلوسايتومتري در ساية افزايش روزافزون تعداد آنتيباديها، تترامرها و رنگهاي توليد شده براي استفاده در ارزيابي فعاليت سلولها به عنوان يك ابزار مهم در مطالعة سلولهاي سيستم ايمني در آمده است. فلوسايتومتري چند رنگي اين امكان را فراهم آورده است كه انواع سلولهاي موجود در نمونة خون يا سلولهاي كشت شده به تفكيك مورد ارزيابي قرار گيرند. سلولهاي تحت مطالعه با استفاده از آنتيباديهاي اختصاصي معرف زير گروههاي سلولي، شناسايي ميشوند و خصوصيات رفتاري آنها نيز با استفاده از آنتيباديهاي اختصاصي (مثلاً ضد سايتوكين) و يا رنگهاي ارزيابي كنندة حيات سلولي تعيين ميشوند. با استفادة همزمان از دو روش آناليز سلولي و جداساز سلولي (cell sorter) امكان مطالعة بيشتر و كشت سلولهاي كاملاً شناخته شده از نظر فنوتايپي يا رفتاري فراهم ميگردد.کارایی فوق العاده فلوسایتومتری در آنالیز فعالیت سلول ها
در حضور يونهاي کلسیم خصوصیات طیفی برخي از رنگهای فلورسنت تغییر مییابد. از اين رنگها براي اندازهگيري تغييرات غلظت كلسيم اجزاء سلولي در هنگامي که سلولها بوسیله انواع محرکها تحریک میشوند استفاده ميشود.بيشترين مورد استفاده از فلوسایتومتری ارزيابي آنتیژنهاي سطحی بیانشده بر روی سلولها ميباشد. اما علاوه بر آن سلولها ممکن است با روشهاي مختلف برای اندازهگیری خصوصیات عملکردی بوسیلة فلوسایتومتری مورد بررسی قرار گیرند. ميتوان تغییرات زماني بیان گیرندهها را تعيين كرد يا برهمكنش یک نوع سلول را با سلول دیگر اندازهگیری نمود. بعلاوه، امكان ارزيابي تغییرات در فعالیت آنزیمها و پتانسیل غشایی وجود دارد. همچنین ميتوان آزمایشاتی برای نشان دادن فاگوسیتوز و آزادسازی مولکولهای فعال زيستي (bioactive) انجام داد.
جداسازی و تخلیص سلول ها با فلوسایتومتری
روش جداسازي سلولها با استفاده از خصوصيات فلورسانس آنها توسط ايمونولوژيستهايي ابداع شد كه تلاش ميكردند جمعيتهاي خالص سلولها را از نمونههاي مختلط تهيه كرده و پس از تكثير آنها در محيط كشت سلولي، نقش مجزاي هر سلول را در سيستم ايمني بررسي نمايند. روشي كه آنها به كار بردند Fluorescence Activated Cell Sorting يا به طور خلاصه FACS ناميده شد. جداسازهاي جرياني (flow sorter) وسايلي ضروري و پرطرفدار در علوم بيولوژيكي و علوم ديگر هستند. كارآيي اصلي اين جداسازها، چنانچه از نامشان بر ميآيد، جدا كردن جمعيتهاي سلولي دلخواه از ميان جمعيتي هتروژن از سلولها براي مطالعة بيشتر ميباشد. بطور كلي اگر سلول يا ذرهاي داراي خصوصيات منحصر به فردي از نظر فيزيكي يا شيميايي باشد با استفاده از آن خصوصيات ميتوان براحتي آن را شناسايي كرده و توسط flow sorter از ديگر سلولهاي همراه جدا كرد.استانداردهای فایل فلوسایتومتری
مبحث مهم ديگر نرم افزارهاي مورد استفاده در فلوسايتومتري هستند. در اوايل، دستگاههاي فلوسايتومتر اطلاعات سلولي جمعآوري شده توسط دستگاه را با فرمت خاصي ذخيره ميكردند كه استفاده مجدد از اطلاعات ذخيره شده در كامپيوترهاي معمولي (PC) غيرممكن ميشد، اما امروزه نسل سوم استانداردهاي فايل فلوسايتومتري ( FCS3 ) تنظيم و تصويب شده است و رعايت اين استانداردها توسط توليد كنندگان دستگاهها سبب شده است تا فايلهاي اطلاعات ذخيره شدة فلوسايتومتري كاربرد عموميتري پيدا كند. نرم افزارهاي مورد استفاده ميتوانند براي جمعآوري اطلاعات و پردازش آنها، ترسيم نمودارهاي يك، دو يا سه بعدي از اطلاعات و يا براي انجام محاسبات رياضي و آماري بر روي اطلاعات به كار برده شوند. معرفي انواع نرم افزارهاي رايج براي باز كردن و مديريت فايلهاي فلوسايتومتري و محاسن و محدوديتهاي هر كدام نيازمند مجالي ديگر است.نتیجه گیری
اگر چه اين مقدمه خيلي حجيم و طولاني شد اما براي ذكر عناوين و موضوعات مطرح در فلوسايتومتري ناگزير از آن بودم اميد است كه بتوانم در روزهاي آينده عناوين مطرح شده را با جزئيات بيشتري براي استفاده خوانندگان عزيز ارائه نمايم. مسلماً آگاهي از نقطه نظرات خوانندگان راهگشاي مسير ارائه اين اطلاعات خواهد بود.پست الکترونیک
:
s_rasoul@yahoo.com
پست الکترونیک
:
soleymanirasool@gmail.com